1,共同点
原子和离子都是构成物质的微粒,属于微观概念。
2,不同点
(1)粒子结构
原子中:质子数=核电荷数=核外电子数
离子中:阳离子,质子数=核电荷数>核外电子数;阴离子,质子数=核电荷数<核外电子数。
(2)微粒的电性
原子:不显电性。因为原子核与核外电子的电量相等电性相反,所以原子不显电性。
离子:阳离子带正电,阴离子带负电,它们所带的电量就是质子数与电子数的差值。
(3)化学符号
原子:就是用元素符号表示,如Na,Mg分别表示钠元素与镁元素,还表示一个钠原子和一个镁原子。
离子:离子符号就是在元素符号或原子团符号的右上角写明离子所带的电量及电性,电量数字写在前面(数字1往往省略不写),电性正负符号写在后面, 如Na+,Mg2+,OH-,阴离子符号 如O2-,S2-等等。
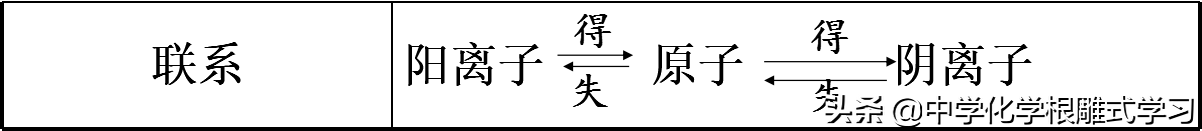
3,相互关系