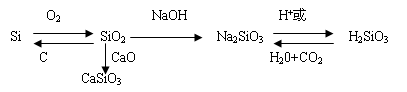从化学角度看材料,材料分为金属材料、非金属材料、有机高分子材料、复合材料。
材料的分类
无机非金属材料主要用于传统工艺上面,比如水泥、陶瓷、玻璃以及耐火材料等,但它不断地焕发着新颜,对现代工艺发展,如建筑、国防、信息方面都具有重要的意义。
作为芯片材料的硅的设计和制造成为了我国重大发展的战略。无机非金属材料的主角——硅,同时也是高考化学中非金属元素的命题热点之一。这部分教学安排比较孤立,是易被学生忽视和遗忘,本文通过梳理硅及其化合物的基础知识,供高中化学会考和高考的学生考前梳理加强记忆的准确性。

硅元素在自然界的存在: 硅在地壳中的含量仅次于 氧 ,硅在自然界的存在形态:只有化合态,没有游离态 (亲氧元素) 主要以 氧化物 和 硅酸盐 形式存在,是构成 岩石 和 矿物 的基本元素。


硅晶体
单质硅也有 晶体 和 无定型 两种同素异形体,晶体硅的结构类似于 金刚石 ,它是带有金属光泽的 灰黑 色固体,熔点 高 ,硬度大 ,有脆性,导电性介于 导体 和 半导体 之间,是良好的 半导体材料 用于做 计算机芯片 、光电池 。
在常温下化学性质 稳定 ,只能与 强碱 、氢氟酸 反应,高温下与 氧气 、 氯气 、 碳 等反应。

石英晶体
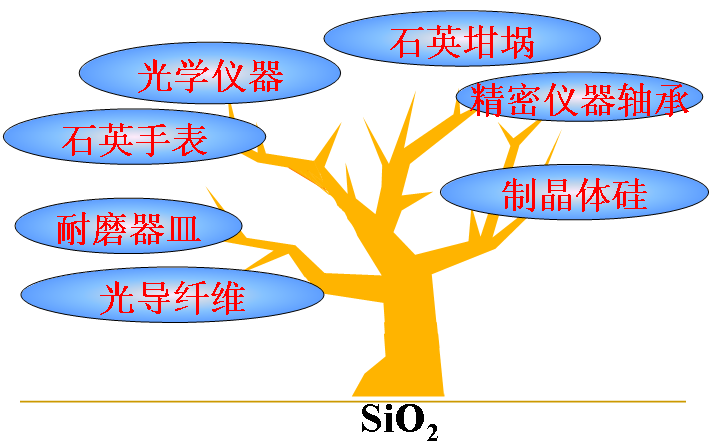
(一)存在和用途:天然二氧化硅的存在形态有 晶体 和 无定型 两大类,统称 硅石 。石英晶体是 结晶 的二氧化硅,具有不同晶型和色彩,其中无色透明的晶体就是通常所说的水晶具有彩色环带状或层状的称为玛瑙 。沙子 中含有少量的石英晶体。

光纤光缆
SiO2是现代光学和 光导纤维 的基本原料。石英制作石英玻璃、石英电子表、石英钟等;水晶常用来制造电子工业的重要部件、光学仪器、工艺品等;石英砂常用作制玻璃和建筑材料。
(二)物理性质:二氧化硅熔点 高 ,硬度 大 ,这些性质是由 正四面体空间网状结构 决定的。
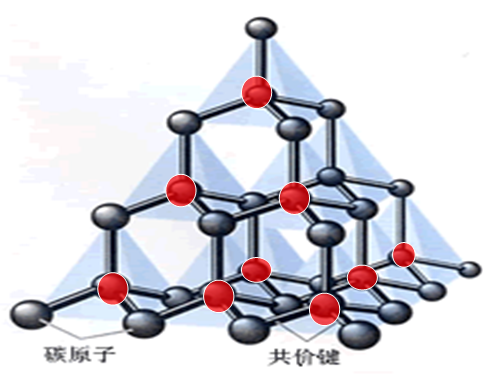
二氧化硅结构
(三)化学性质
(1)酸性氧化物通性:
SiO2与强碱反应,化学方程式为: SiO2+2NaOH==Na2SiO3+H2O,离子方程式 SiO2+2OH—==SiO32—+H2O

实验室中盛放NaOH 溶液的试剂瓶用 橡胶 塞,而不用 玻璃塞 。
SiO2能与碱性氧化物反应: SiO2+CaO=高温==CaSiO3
SiO2 不 溶于水, 不 与水反应
(2)SiO2的特性:
SiO2不与强酸反应,只能与HF 反应,这是SiO2的特性。化学方程式为SiO2+4HF==SiF4↑+2H2O 用于 刻蚀玻璃 。

(3)SiO2弱氧化性 SiO2+2C =高温=Si+2CO ↑(二氧化硅制取单质硅的原理)

高纯硅的制法
注意:二氧化碳二氧化硅的异同
二氧化硅在常温只能与 强碱 、氢氟酸 反应,高温下与 碳 、 碱性氧化物 、碳酸盐 反应。
制备:硅酸是通过 可溶性硅酸盐 与 强酸 反应制得的
化学方程式: Na2SiO3+2HCl==2NaCl+H2SiO3(胶体) 、Na2SiO3+CO2+H2O==H2SiO3(胶体)+Na2CO3

硅胶
硅酸的物理性质: 白色、胶状、难溶固体 硅胶的用途: 干燥剂、催化剂的载体 硅酸的化学性质:酸性:H2SiO3+NaOH = Na2SiO3 +H2O
不稳定性: H2SiO3 =加热= SiO2 +H2O
硅酸盐是由 金属 、 硅 和 氧 组成的化合物的总称。硅酸盐大多 难 溶于水,化学性质 稳定 。 硅酸盐是构成地壳岩石的主要成分,种类多,结构复杂,常用氧化物的形式来表示组成。其表示方式:活泼金属氧化物·较活泼金属氧化物·二氧化硅·水。如:滑石Mg3(Si4O10)(OH)2可表示为3MgO·4SiO2·H2O
Na2SiO3 易 溶于水,其水溶液俗称为 水玻璃 ,可做 粘合剂 是制备硅胶 和耐火材料的原料。

传统的硅酸盐制品有 陶瓷 、 玻璃 、 水泥 。
它们的原料分别为 黏土 、 纯碱、石灰石和石英 、 黏土和石灰石 。(注意:只有陶瓷中没有石灰石原料)
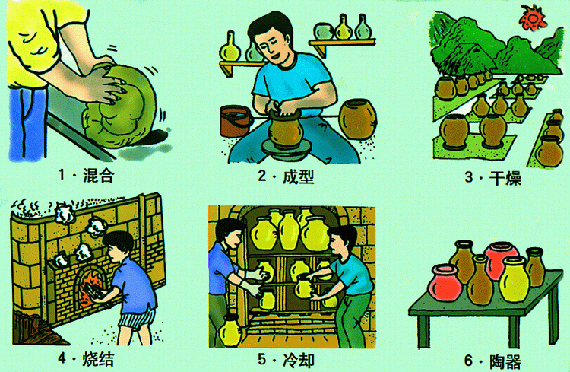
陶瓷烧制过程

水泥的制备

玻璃的制备
还有一些特殊功能的含硅物质有碳化硅(SiC,俗称金刚砂硬度大)硅钢:(含4%硅),导磁性良好、 硅橡胶:既耐高又耐磨。